飼糧中添加酵母培養物對舍飼牦牛瘤胃發酵參數及微生物區系的影響
摘 要:本試驗旨在研究飼糧中添加酵母培養物(YC)對舍飼牦牛瘤胃發酵參數及微生物區系的影響。試驗選取4歲、初始體重為(180.31±29.73)kg的健康麥洼公牦牛36頭,隨機分為4組,每組9個重復,每個重復1頭牦牛,分別飼喂YC添加水平為0(Ⅰ組)、0.5%(Ⅱ組)、1.0%(Ⅲ組)和1.5%(Ⅳ組)的全混合日糧。預試期10d,正試期80d。結果表明:1)隨著飼糧YC添加水平的升高,瘤胃微生物蛋白(MCP)含量顯著升高(P<0.05),pH有呈線性降低的趨勢(P=0.058),氨態氮(NH3⁃N)含量有呈二次曲線變化的趨勢(P=0.055),乙酸比例及乙酸/丙酸呈顯著線性降低(P<0.05),丙酸和丁酸比例呈顯著線性增加(P<0.05),總揮發性脂肪酸(TVFA)含量無顯著變化(P>0.05)。2)舍飼牦牛瘤胃微生物多樣性指數除Chao指數外,其余各指數組間無顯著差異(P>0.05)。3)門水平上,4組的優勢菌門均為擬桿菌門、厚壁菌門和變形菌門。隨著飼糧YC添加水平的升高,疣微菌門的相對豐度呈顯著線性升高(P<0.05),Saccharibacteria的相對豐度呈顯著線性降低(P<0.05),互養菌門的相對豐度呈顯著二次曲線變化(P<0.05),變形菌門和纖維桿菌門的相對豐度有呈二次曲線變化的趨勢(P=0.065,P=0.064)。屬水平上,普雷沃菌屬、擬桿菌目BS11和理研菌科RC9為優勢菌屬,隨著飼糧YC添加水平的升高,克里斯滕森菌科R7的相對豐度呈顯著線性降低(P<0.05),與pH和NH3⁃N含量呈顯著正相關(r>0.500,P<0.05),奎因氏菌屬的相對豐度呈顯著線性降低(P<0.05),與TVFA含量呈顯著正相關(r=0.460,P<0.05),瘤胃球菌科UCG⁃001和瘤胃球菌科UCG⁃014的相對豐度呈顯著線性降低(P<0.05),與pH呈顯著正相關(r>0.500,P<0.05),瘤胃球菌科UCG⁃011和瘤胃球菌屬2的相對豐度呈顯著二次曲線變化(P<0.05)。綜上所述,在舍飼牦牛飼糧中添加YC顯著影響了瘤胃中微生物的豐富度,影響門和屬水平微生物的組成,進而對瘤胃發酵參數產生影響。
反芻動物瘤胃中棲息著復雜、多樣的原蟲、細菌、古細菌及真菌等多種微生物,它們之間的相互作用對維持瘤胃內環境穩定和動物健康至關重要。動物的年齡、飼糧結構、健康狀況等均會影響瘤胃發酵參數和微生物區系多樣性,其中飼糧結構是最主要的因素。酵母培養物(YC)是酵母菌在特定工藝條件下發酵培養后產生的一種微生態制劑,富含糖類、蛋白質、維生素、礦物質、免疫多糖、消化酶等成分,可為微生物的生長提供豐富的營養物質。有研究表明,YC可維持瘤胃健康及腸道菌群平衡,提高免疫力及營養物質消化率,促進動物的生長,提高動物的生長性能。向洋研究發現,荷斯坦奶牛飼糧中添加15g/d的YC可提高纖維消化率及微生物蛋白(MCP)的產量,進而改善泌乳性能。Williams等研究表明,在奶牛飼糧中添加釀酒YC可有效地維持瘤胃內環境的穩定。Price等研究報道,在被沙門氏菌感染的斷奶仔豬飼糧中添加0.2%YC可增加胃腸道中乳酸菌和擬桿菌的數量,改善微生物區系。Liu等研究發現,YC能影響瘤胃微生物門水平和屬水平的相對豐度,進而改變瘤胃微生物區系組成。
牦牛(Bos grunniens)作為青藏高原地區特有的家畜,與當地居民的生活息息相關,被稱之為“高原之舟”,但長期以來“靠天養畜”的養殖模式極大地限制了牦牛的生產效率。為了改善牦牛生產現狀、促進牦牛產業化發展,近年來研究者們通過借鑒肉牛養殖經驗開展牦牛的舍飼育肥工作,但主要集中在提高生長性能、消化率和改善肉品質等方面的研究,關于舍飼牦牛瘤胃微生物區系的研究鮮有報道。另外,YC在反芻動物中的應用已經趨于成熟,但未見YC在舍飼牦牛瘤胃發酵參數和微生物區系研究的報道。鑒于此,本試驗在舍飼牦牛飼糧中添加不同水平的YC,對舍飼牦牛瘤胃發酵參數和微生物區系多樣性進行研究,以期為YC在牦牛飼糧中的應用和牦牛飼糧的合理配制提供理論基礎。
1材料與方法
1.1 試驗時間和地點
本試驗于2017年11月至2018年3月在四川省阿壩藏族羌族自治州茂縣南新鎮(東經103°73′,北緯31°57′)進行。該地區平均海拔約1500m,屬于高原性季風氣候,干燥、多風。試驗期間,用高低溫溫度計(河北省衡水市順發儀器儀表廠)測得牦牛圈舍內溫度在4~25℃。
1.2 試驗設計
本試驗采用單因素隨機試驗設計,選取36頭4歲左右、體重相近[(180.31±29.73)kg]、健康的麥洼公牦牛隨機分為4組,每組9個重復,每個重復1頭牦牛,Ⅰ、Ⅱ、Ⅲ和Ⅳ組飼喂YC添加水平分別為0、0.5%、1.0%和1.5%的全混合日糧(TMR)。試驗期90d,其中預試期10d,正試期80d。
1.3 試驗飼糧
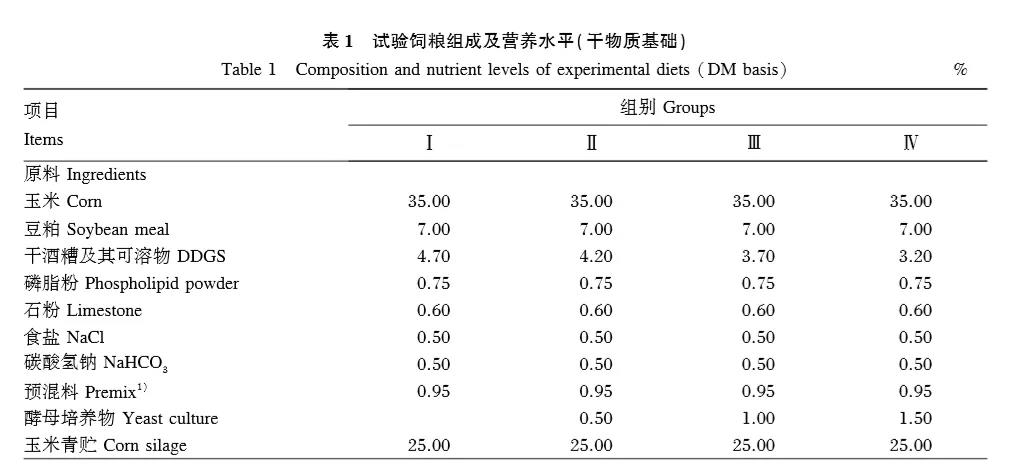
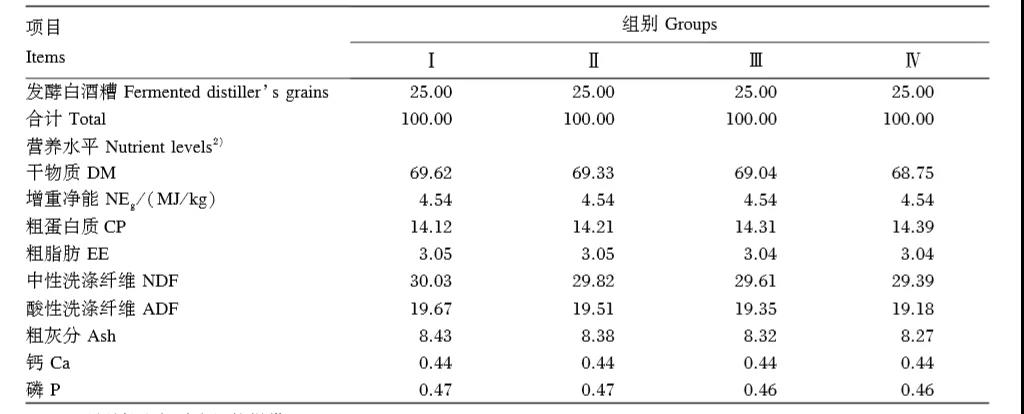
試驗飼糧參照本課題組前期研究設計,由精料和粗料(青貯玉米、發酵酒糟)按50∶50混合配制成TMR,其組成及營養水平見表1。YC由美國國際生物營養科技有限公司(BioNutrition International,Inc)提供,為黃色流動性良好的細小顆粒,其營養成分含量如下:粗蛋白質≥18.0%、粗脂肪≥1.5%、粗纖維≤12.0%、水分≤12.0%、粗灰分≤6.0%。
1.4 飼養管理
試驗開始前,做好圈舍清潔和消毒等準備工作。牦牛進場后,待其精神狀況良好后皮下注射伊維菌素注射液進行驅蟲,2周后進行再次驅蟲,驅蟲完成后進入預試期。試驗牦牛采用舍飼分欄栓系飼養,占地面積約3m2。每天按預估采食量供給TMR,分別在07:00和16:00各飼喂1次。自由采食,自由飲水。每天記錄投料量和剩料量,計算每日采食量。
1.5 樣品采集及測定
1.5.1 瘤胃液的采集
試驗結束當天晨飼前,每組隨機選取5頭牦牛采用口腔導管采集瘤胃液,棄去最初的50mL(避免唾液的影響),然后分裝于15mL離心管和5mL凍存管中,15mL離心管-20℃保存,用于氨態氮(NH3⁃N)、MCP、揮發性脂肪酸(VFA)含量的測定;5mL凍存管立即投入液氮中保存,用于細菌菌群多樣性的測定。
1.5.2 樣品的測定
飼糧中干物質、粗蛋白質、粗脂肪、粗灰分、鈣和磷含量參照國家相關標準進行測定,中性洗滌纖維(NDF)和酸性洗滌纖維(ADF)含量參照Van Soest等方法進行測定。
pH:采用PHS-10型便攜式pH計測定。
NH3⁃N含量:參照馮宗慈等的比色法測定。
MCP含量:參照Bradford提出的考馬斯亮藍法測定。將瘤胃液渦旋振蕩1min,使微生物與食糜分離,在4℃下309×g離心5min,取上清液1.5mL于2mL EP管中,4℃下15640×g離心30min,棄上清液,底物中加入1.5mL0.5mol/L的NaOH溶液混勻,100℃水浴15min,再4℃下15640×g離心30min,取上清液加入3mL考馬斯亮藍染液(現配現用),振蕩混勻后靜置10min,用721型分光光度計在波長595nm處比色。
VFA含量:用Agilent 6890N氣相色譜儀測定。以2-乙基丁酸(2EB)作為內標物,采用內標校正定量方法進行計算。載氣為氮氣(N2),分流比40∶1,流量2.0mL/min,平均線速度38cm/s,柱壓11.3psi,采用程序升溫,初始溫度為120℃(3min),以10℃/min升溫至180℃(1min),氫焰檢測器溫度為250℃,氫氣(H2)流量40mL/min,空氣流量450mL/min,柱流量+尾吹氣流量45mL/min,進樣口溫度為210℃,進樣量為0.6μL。
1.5.3 瘤胃細菌多樣性
根據OMEGA⁃soil DNA試劑盒(Omega Biotek,美國)說明書進行總DNA抽提,DNA濃度和純度利用NanoDrop2000進行檢測,利用1%瓊脂糖凝膠電泳提取得到的DNA進行質量檢測;然后用338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)引物對V3~V4可變區進行PCR擴增,擴增程序為:95℃預變性3min,27個循環(95℃變性30s,55℃退火30s,72℃延伸30s),最后72℃延伸10min(PCR儀:ABI GeneAmp 9700型)。擴增體系為20μL:4μL5×FastPfu緩沖液,2μL2.5mmol/L dNTPs,0.8μL引物(5μmol/L),0.4μL FastPfu聚合酶,10ngDNA模板。
使用2%瓊脂糖凝膠回收PCR產物,利用AxyPrep DNA Gel Extraction Kit(Axygen Biosciences,美國)進行純化,Tris⁃HCl洗脫,2%瓊脂糖電泳檢測。利用QuantiFluorTM⁃ST(Promega,美國)進行定量檢測。然后用純化后的擴增片段構建Miseq PE 2×300的文庫,采用Illumina MiSeq平臺(Illumina,美國)進行測序(上海美吉生物醫藥科技有限公司)。
原始測序序列使用Trimmomatic軟件質控,使用FLASH軟件進行拼接,使用的UPARSE軟件(version 7.1http://drive5.com/uparse/)根據97%的相似度對序列進行操作分類單元(OTU)聚類,并在聚類的過程中去除單序列和嵌合體。利用RDPclassifier(http://rdp.cme.msu.edu/)對每條序列進行物種分類注釋,比對Silva數據庫(SSU128),設置比對閾值為70%。
1.6 數據分析
數據通過Excel 2010整理后,再使用SPSS 24.0進行單因素方差分析,采用Duncan氏法進行多重比較,隨后對YC添加水平進行線性(linear)和二次曲線(quadratic)的回歸分析。結果以平均值±標準差表示,P≤0.05表示差異顯著,P>0.05表示差異不顯著,0.05<P<0.10表示有趨勢。
2結果與分析
2.1 飼糧中添加YC對牦牛瘤胃發酵參數的影響
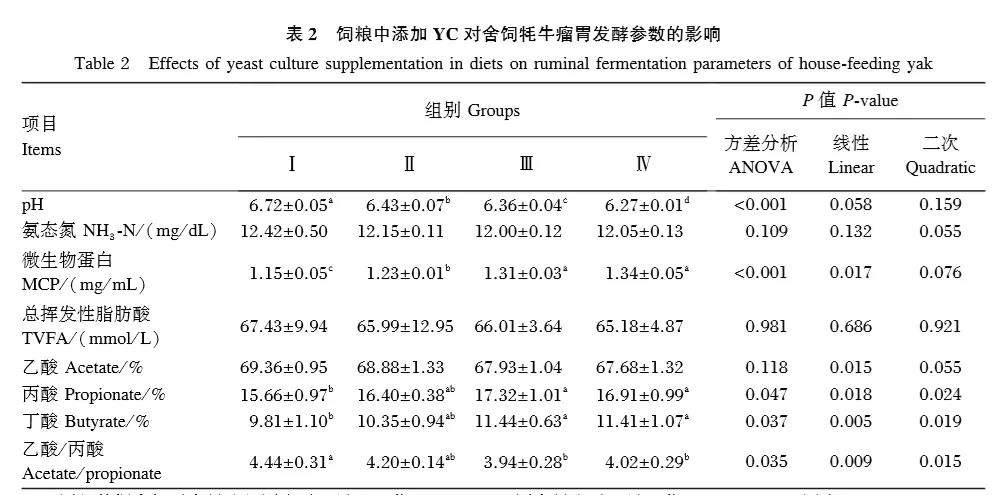
由表2可知,Ⅲ組MCP含量顯著高于Ⅰ、Ⅱ組(P<0.05),與Ⅳ組差異不顯著(P>0.05),Ⅱ組顯著高于Ⅰ組(P<0.05);隨著飼糧中YC添加水平的升高,牦牛瘤胃液pH有呈線性降低的趨勢(P=0.058),NH3⁃N含量有呈二次曲線變化的趨勢(P=0.055),乙酸比例及乙酸/丙酸呈顯著線性降低(P<0.05),丙酸和丁酸比例呈顯著線性增加(P<0.05),總揮發性脂肪酸(TVFA)含量無顯著變化(P>0.05)。
2.2 飼糧中添加YC對牦牛瘤胃內微生物區系的影響
2.2.1 alpha多樣性分析
通過MiSeq測序,20個樣本中共獲得917770條優質細菌16S rRNA基因序列,每個樣本平均產生45889條,序列平均長度為440bp。由表3可知,4個組的覆蓋度均大于0.99,能準確地反映牦牛瘤胃中細菌的組成。Ⅱ組Chao指數顯著高于Ⅰ組(P<0.05),與Ⅲ、Ⅳ組差異不顯著(P>0.05),其余各指標組間均無顯著差異(P>0.05)。
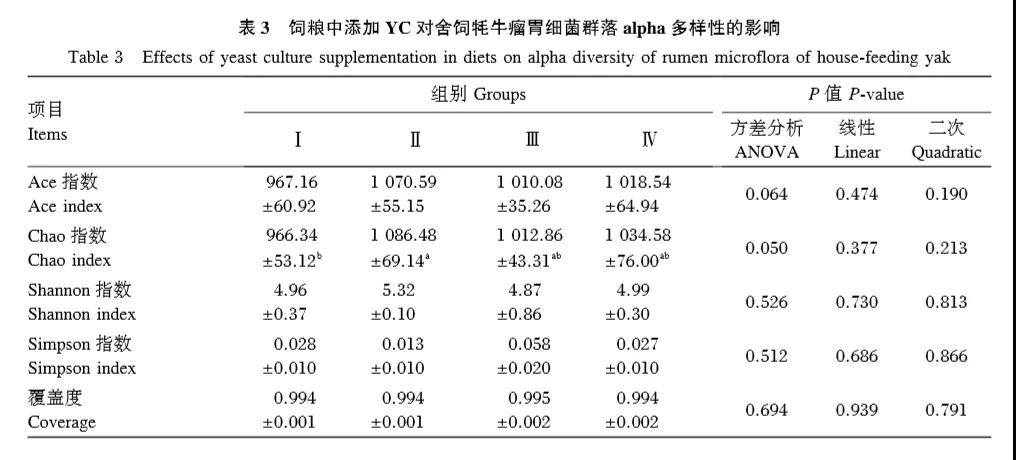
2.2.2 Venn圖分析
在相似度為97%的水平下,4個組共聚類得到1463個OUT,Ⅰ、Ⅱ、Ⅲ和Ⅳ組OUT數分別為1273、1346、1315和1334個,共用1109個OUT,占OUT總數的75.8%,獨有的OUT數分別為9、20、11和31個,占OUT總數的比例分別為0.71%、1.46%、0.84%和2.32%,表明各組OUT組成相似度較高,差異較小。

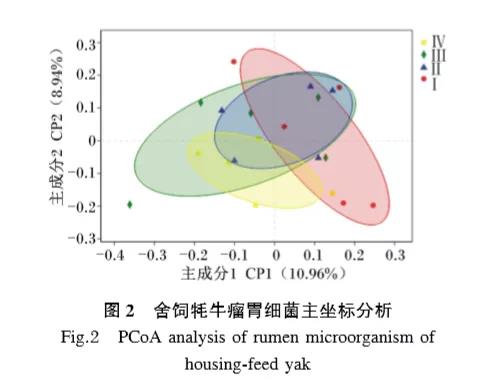
2.2.3 主坐標分析(PCoA)
瘤胃細菌OUT水平上基于braycurtis距離計算的主坐標分析結果見圖2,2個樣本間的距離代表這2個樣本組成的相似性與差異性,其距離越近,2個樣本的相似性越高。如圖2所示,主成分1和主成分2的貢獻值分別為10.96%和8.94%。與Ⅰ組相比,Ⅱ、Ⅲ組細菌組成差異較小,而Ⅳ組差異較大,表明在舍飼牦牛飼糧中添加1.5%的YC可以改變瘤胃細菌區系的組成。
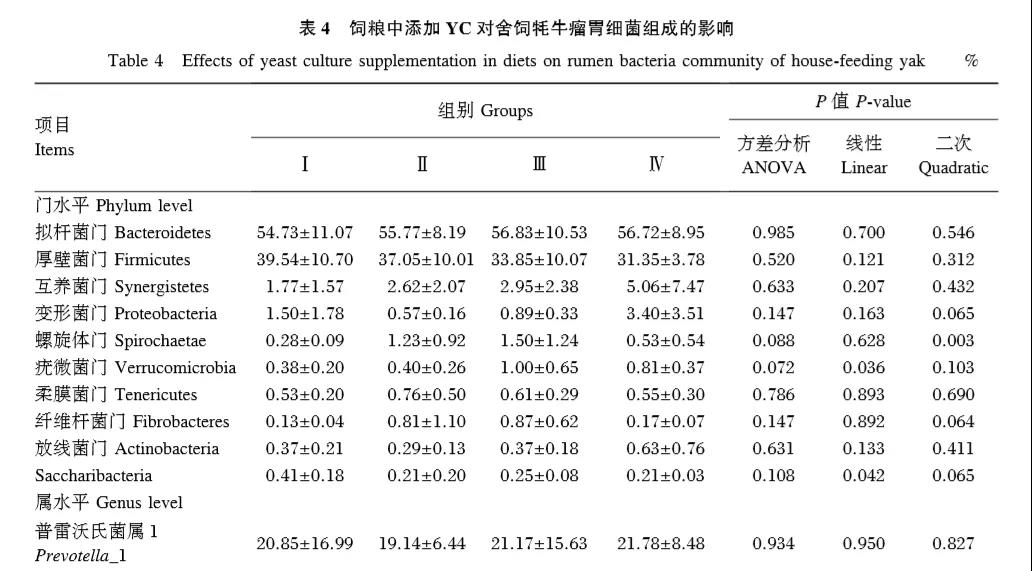
2.2.4 瘤胃細菌組成分析
本次測序經過序列比對和注釋,20個樣本共得到17個門、30個綱、49個目、81個科、210個屬。由表4可知,4個組在門水平上的優勢菌群均為擬桿菌門、厚壁菌門和變形菌門,其相對豐度均在1%以上。隨著飼糧中YC添加水平的升高,疣微菌門的相對豐度呈顯著線性升高(P<0.05),Saccharibacteria的相對豐度呈顯著線性降低(P<0.05),互養菌門的相對豐度呈顯著二次曲線變化(P<0.05),變形菌門和纖維桿菌門的相對豐度有呈二次曲線變化的趨勢(P=0.065,P=0.064)。
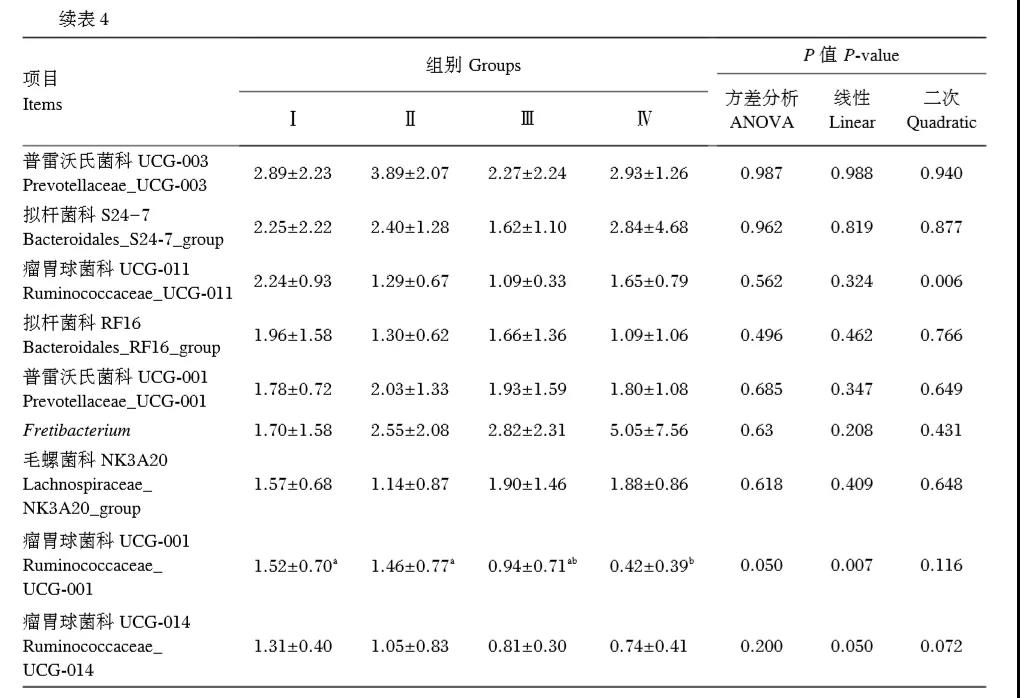
在屬水平上,4個組的優勢菌屬均為普雷沃氏菌屬1、擬桿菌目BS11和理研菌科RC9,其相對豐度均在5%以上。同時,隨著飼糧中YC添加水平的升高,克里斯藤菌科R7、奎因氏菌屬、瘤胃球菌科UCG⁃001和瘤胃球菌科UCG⁃014的相對豐度呈顯著線性降低(P<0.05),瘤胃球菌科UCG⁃011和瘤胃球菌屬2的相對豐度呈顯著二次曲線變化(P<0.05)。
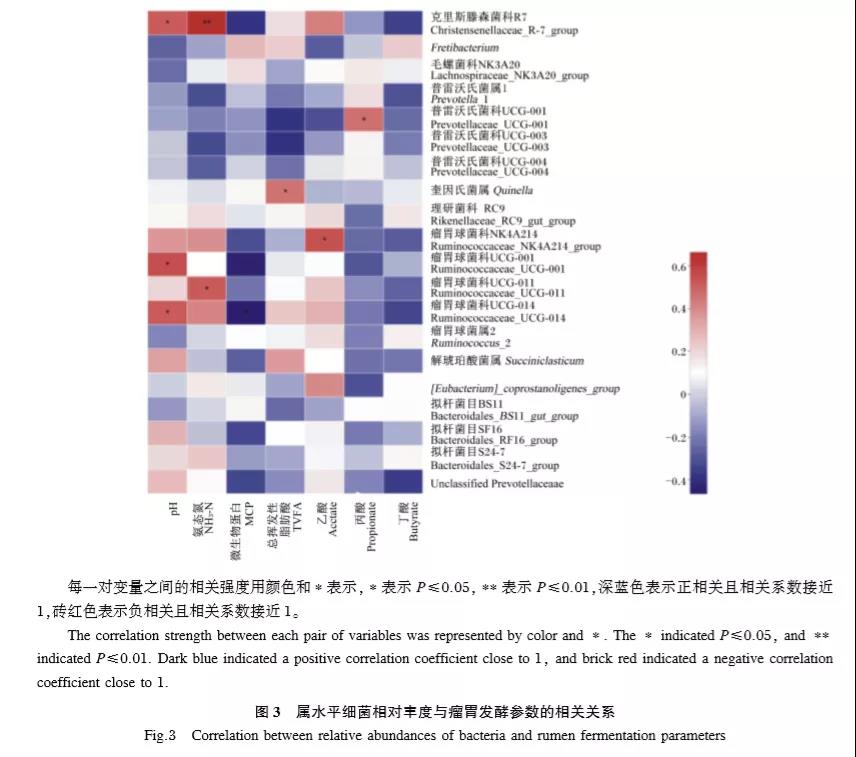
2.2.5 屬水平細菌相對豐度與瘤胃發酵參數的相關性分析
圖3展示了舍飼牦牛瘤胃細菌屬水平相對豐度(排名前20的菌屬)與發酵參數的相關關系。其中,pH與克里斯滕森菌科R7(r=0.520,P=0.019)、瘤胃球菌科UCG⁃001(r=0.557,P=0.011)和瘤胃球菌科UCG⁃014(r=0.522,P=0.018)的相對豐度呈顯著正相關,NH3⁃N含量與克里斯滕森菌科R7(r=0.664,P=0.001)和瘤胃球菌科UCG⁃011(r=0.521,P=0.018)的相對豐度呈顯著正相關,MCP含量與瘤胃球菌科UCG⁃014的相對豐度呈顯著負相關(r=-0.466,P=0.038),TVFA含量與奎因氏菌屬的相對豐度呈顯著正相關(r=0.460,P=0.041),乙酸與瘤胃球菌科NK4A214的相對豐度呈顯著正相關(r=0.546,P=0.013),丙酸比例與普雷沃氏菌科UCG⁃001的相對豐度呈顯著正相關(r=0.469,P=0.037)。
3討論
3.1 飼糧中添加YC對舍飼牦牛瘤胃發酵參數的影響
瘤胃pH是瘤胃生理狀況的最直接表現,與飼糧組成和營養成分密切相關,可綜合反映瘤胃微生物代謝和有機酸產生、吸收、排除及中和的狀況。Yoon等研究表明,反芻動物瘤胃pH為6.2~6.8時,瘤胃中發酵纖維物質的微生物活性最高,pH為5.5~6.0時,瘤胃中發酵淀粉的微生物活性最強,當瘤胃pH降低到5.5以下時,動物容易出現酸中毒。本試驗中,各組pH均處于正常生理范圍內,隨著YC添加水平的升高呈線性降低的趨勢,與Erasmus等在奶牛中的研究結果一致,可能是由于YC促進了飼糧中營養物質的快速降解,加速有機酸的積累,導致瘤胃pH下降。
NH3⁃N的含量可直接反映瘤胃中微生物生長狀況,也是MCP合成主要原料。研究表明最適宜瘤胃微生物生長的NH3⁃N含量為10~50mg/dL。本試驗中,隨著YC添加水平的升高,NH3⁃N含量逐漸降低,與Erasmus等的結果一致,在奶牛飼糧中添加YC能降低瘤胃NH3⁃N含量。而Hristov等在奶牛中的研究發現,YC對瘤胃含量無顯著影響,Liu等在綿羊的飼糧中添加YC能夠增加瘤胃NH3⁃N含量。不同的結果可能與動物品種、飼糧組成、YC的來源、添加形式等有關。瘤胃內NH3⁃N和MCP的含量密切相關,MCP的含量可以反映微生物攝取和利用NH3⁃N的能力。本試驗中,隨著YC添加水平的升高,MCP的含量線性升高,與Dias等的研究結果一致,在泌乳奶牛飼糧中添加YC降低了瘤胃NH3⁃N含量,增加了MCP的合成。Yoon等研究表明,YC能提高瘤胃微生物的活性和生長繁殖,刺激蛋白分解菌的生長,加快NH3⁃N的生成和MCP的合成。
VFA是瘤胃內碳水化合物發酵的主要產物,是反芻動物主要的能量來源,包括乙酸、丙酸、丁酸及少數短鏈脂肪酸和支鏈脂肪酸。乙酸、丙酸和丁酸含量較高,其含量約占TVFA的95%左右,其中丙酸的轉化效率最高,乙酸最低。丙酸在糖異生作用下合成葡萄糖,乙酸是乳脂合成的主要前體,在動物生產中丙酸比例越高,可為機體提供的能量越高。研究表明,在反芻動物飼糧中添加YC可增加VFA的含量,也有研究表明,瘤胃中VFA的含量與YC的添加水平無顯著關系。本試驗中,隨著YC添加水平的升高,瘤胃內乙酸比例和乙酸/丙酸顯著降低,丙酸比例顯著增加。與Harrison等在泌乳奶牛飼糧中添加YC增加瘤胃丙酸比例和降低乙酸比例的結果一致。這說明在舍飼牦牛飼糧中添加YC可以使牦牛瘤胃發酵類型由乙酸型向丙酸型轉變,在采食量相同的情況下,促進舍飼牦牛的增重。
3.2 飼糧中添加YC對舍飼牦牛瘤胃微生物區系的影響
16S rRNA高通量測序技術可以很好地揭示反芻動物瘤胃微生物多樣性。本試驗中,20個樣品通過Illumina MiSeq平臺測序后共獲得917770條優化序列,平均長度為440bp,共聚類得到1463個OTU。略高于楊琦玥等在牦牛中的研究結果。Mao等研究發現,覆蓋度高于97%說明測序樣品取樣充分。本試驗中各組覆蓋度均高于0.99,說明本次測序結果能真實地反映舍飼牦牛瘤胃細菌群落種類和結構多樣性。Shannon指數和Simpson指數可反映瘤胃菌群的多樣性,Shannon指數越大,群落多樣性越高;Simpson指數越小,群落多樣性越高。Ace指數和Chao指數可反映瘤胃菌群的豐富度,其數值越大,群落豐富度越高。本試驗中,在舍飼牦牛中添加YC不會影響瘤胃細菌多樣性,但會增加瘤胃細菌的豐富度。
研究表明,擬桿菌門和厚壁菌門是反芻動物瘤胃中的優勢菌門。牦牛瘤胃中的優勢菌門為擬桿菌門、厚壁菌門、變形菌門和螺旋菌門,本試驗中,舍飼牦牛瘤胃優勢菌門為擬桿菌門、厚壁菌門和變形菌門,與前人研究基本一致。Evans等研究發現,擬桿菌門在非纖維物質的降解中發揮重要作用,而厚壁菌門主要參與纖維物質的分解。非纖維物質經瘤胃發酵后產生丙酸,而纖維物質被降解后主要產生乙酸。本試驗中,隨著YC添加水平的升高,擬桿菌門相對豐度逐漸增加,厚壁菌門的相對豐度逐漸降低,但差異不顯著,同時,丙酸比例線性升高,乙酸比例線性降低。這可能與本試驗在舍飼條件下進行,牦牛采食了大量的精料,使得分解淀粉、可溶性碳水化合物的擬桿菌門的相對豐度升高有關。這說明YC可促進擬桿菌門微生物的生長、增殖,降解飼糧中非纖維類物質產生更多的丙酸。螺旋菌門能夠降解纖維素、半纖維素、果膠等,對植物類纖維物質轉化為VFA產生重要影響。本試驗中,螺旋菌門的相對豐度先升高后降低,呈二次曲線變化。這表明在牦牛飼糧中添加1%的YC可促進瘤胃微生物對纖維類物質的降解,同時與纖維降解密切相關的纖維桿菌門也呈現相似的變化趨勢,其在Ⅲ組(1%)纖維桿菌門相對豐度最高。這說明VFA含量與組成的變化可能與不同微生物對纖維物質和非纖維物質降解程度有關。疣微菌門在哺乳動物胃腸道免疫耐受中起主要作用,其物種豐度的減少或缺失與宿主免疫力的下降密切相關。本研究中,隨著YC添加水平的升高,疣微菌門的相對豐度線性升高。這表明在飼糧中添加YC可能與增強機體免疫力相關。
張紅濤研究荷斯坦后備牛瘤胃微生物組成時發現,普雷沃氏菌屬和琥珀酸菌屬是瘤胃細菌區系的優勢菌屬。高雨飛通過測序發現錦江牛瘤胃細菌多樣性發現在屬水平普雷沃氏菌屬、帕拉普氏菌屬、理研菌屬是優勢菌屬。本試驗中,舍飼牦牛瘤胃中優勢菌屬為普雷沃氏菌屬1、擬桿菌目BS11和理研菌科RC9,與前人研究結果不完全一致,推測可能由動物品種、年齡、飼糧結構、飼養管理等不同引起的。普雷沃氏菌屬是瘤胃中數量最多的一類擬桿菌門菌屬,參與多種微生物代謝、具有較高活性的半纖維素降解能力和適應不同飼糧結構的能力,在粗蛋白質、淀粉、木聚糖和果膠的降解過程中發揮重要作用。本試驗中,普雷沃氏菌屬1的相對豐度最高,與前人研究結果一致,且各組間差異不顯著。這可能是本研究飼糧粗蛋白質和能量水平相近,沒有對普雷沃氏菌屬的相對豐度產生顯著影響。瘤胃球菌屬包括黃色瘤胃球菌和白色瘤胃球菌,是瘤胃中主要的纖維降解菌,能產生大量的纖維素酶、半纖維素酶和木聚糖酶,降解粗飼料中的纖維素和半纖維素。本研究中,瘤胃球菌屬2的相對豐度呈二次曲線變化,表明在舍飼牦牛飼糧中添加YC可以促進瘤胃球菌的生長、增殖,提高飼糧中纖維的降解率。瘤胃菌科是厚壁菌門中一種革蘭氏陰性菌,可降解纖維物質產生乙酸。本試驗中,瘤胃球菌科UCG⁃011、瘤胃球菌科UCG⁃001和瘤胃球菌科UCG⁃014的相對豐度隨YC添加水平的升高而線性降低,使得乙酸比例呈線性降低,推測可能與YC促進非纖維降解菌的生長、增殖和飼養管理方式有關。同時,本試驗還發現瘤胃球菌科NK4A214的相對豐度與乙酸比例呈顯著正相關,且瘤胃球菌科UCG⁃001和瘤胃球菌科UCG⁃014的相對豐度與瘤胃液pH呈顯著正相關,NH3⁃N含量與瘤胃球菌科UCG⁃011的相對豐度呈顯著正相關。這說明疣微菌科不同屬的代謝能力不同,其中NK4A214_group、UCG⁃001和UCG⁃014菌屬可能參與VFA代謝,而UCG⁃011屬的相對豐度可能與NH3⁃N含量的產生密切相關。克里斯滕森菌科屬于厚壁菌門,在維持胃腸道結構和功能和動物機體免疫調節方面發揮重要作用。本試驗中,克里斯滕森菌科R7的相對豐度隨著YC添加水平的升高而降低,且與瘤胃pH和NH3⁃N含量呈顯著正相關,表明克里斯滕森菌科與VFA和NH3⁃N的代謝相關,說明YC通過改善瘤胃微生物相對豐度,維持腸道結構和功能,進而調節機體的免疫力。
4結論
在舍飼牦牛飼糧中添加YC,可增加舍飼牦牛瘤胃細菌的豐富度,進而對門和屬水平部分細菌的相對豐度產生影響,最終影響瘤胃液中pH、MCP含量和乙酸、丙酸、丁酸比例。

相關鏈接:99多功能飼料發酵劑——高濃度乳酸菌為主的固態飼料發酵劑,更輕易成功、效果更好的生物飼料發酵劑,簡單好用的中草藥發酵劑
【視頻】部分發酵飼料養豬雞鴨帶給你無臭味健康無抗養殖效果
相關鏈接——
①.99多功能飼料發酵劑——高濃度乳酸菌為主的固態飼料發酵劑,更輕易成功、效果更好的生物飼料發酵劑,簡單好用的中草藥發酵劑
②.99多功能飼料發酵劑,酶菌結合飼料發酵劑中的佼佼者,幾項數據對比讓你信服
③.【視頻】部分發酵飼料養豬雞鴨帶給你無臭味健康無抗養殖效果
⑤.御瘟湯——防控非洲豬瘟增加自制發酵中草藥體內外運用的原生中草藥配方
⑥.動物促生長增肥原生中草藥組方——效果直觀可見,生長速度提高顯著,降低料耗提前出欄
⑦.“土味十足”原生中草藥配方——效果顯著的動物肉蛋品質改良中草藥配方,比放養更土味十足
10.豬場復產成功案例,防控非洲豬瘟運用自制發酵中草藥更易成功,不需大設施投入成本低廉
12.2020年多年生禾本科高產牧草品種推薦,亞熱帶與大棚內可四季產出,提供專業種植、加工、利用、形成生態循環一條龍服務
13.養殖場廢水(污水)最簡單的快速處理技術,達標農灌水或者變成無臭味不燒苗的液態有機肥技術
14.新建豬場用哪種模式好?新型水泡糞技術模式節約30%以上建設成本與減少70%以上糞污處理環保建設
15.豬場復養如何才能成功?推薦自制發酵中草藥組合拳模式!數百成功案例歡迎驗證
16.豬場發現疑似感染非洲豬瘟后如何快速控制下來(20余天達到滿意效果,有大量成功案例)
17.養殖場托管找廣西助農公司,無專業技術員也能夠高效益生產,總有一種模式適合你
- 上一篇:將牧草粉碎進行簡單發酵或者直接拌料部分養雞,比較小范圍放養改善肉質更有保障 [2020-10-25]
- 下一篇:豬傳染性胃腸炎的防治 [2020-10-24]